■セミナー便り
1.ビジンプロ「第1世代に優位性を示した」-近畿大学医学部:中川和彦教授-
■記者会見
1.19年の活動方針発表「18年の薬価改定を是正する年」-PhRMA在日執行委員会:パトリック・ジョンソン委員長-
■行政トピックス
1.厚生科学審議会臨床研究部会2月15日特定臨床研究結果の薬事承認申請への活用が論点に
■セミナー便り
1.ビジンプロ「第1世代に優位性を示した」
-近畿大学医学部:中川和彦教授-
近畿大学医学部内科学教室腫瘍内科部門の中川和彦教授は2月4日、ファイザーが1月にEGFR遺伝子変異陽性の手術不能または再発非小細胞肺がんの適応で承認を取得したEGFRチロシンキナーゼ阻害剤(TKI)ビジンプロ(ダコミチニブ)について、同社主催のメディア向けセミナーで「第1世代のゲフィチニブもしくはエルロチニブに第3相試験で優位性を示した薬がオシメルチニブとダコミチニブという2つの薬剤になった」と紹介した。
ビジンプロは化学療法歴のないEGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺がん患者を対象にした国際共同第3相ARCHER1050試験でイレッサ(ゲフィチニブ)と比較して主要評価項目の無増悪生存期間(PFS)および副次評価項目の全生存期間(OS)で統計学的に有意な延長を示した。
この結果を受けて、日本肺癌学会の肺癌診療ガイドライン2018年版で、4期非小細胞肺がんのEGFR遺伝子変異陽性のPS0-1の場合の1次治療で「ダコミチニブを行うよう提案する(推奨の強さ2)」となった。
なお、オシメルチニブとはアストラゼネカのEGFR-TKIタグリッソのことで、同剤は16年3月にEGFR-TKIに抵抗性のEGFR T790M変異陽性の手術不能または再発非小細胞肺がんの適応(2次治療)で承認を取得し、18年8月にEGFR遺伝子変異陽性の手術不能または再発非小細胞肺がん(1次治療)に適応拡大した。
中川教授は薬剤の使い分けについて「患者がどういう生活をしたいかが一番だろうと思う。その意味では副作用が少なくて普通の生活を保ちたいと強く願う場合はオシメルチニブが選択される場合が多い」と語る。一方で「もし1次治療でオシメルチニブ以外の治療方法を行った人が全員、2次治療でT790M変異の有無に関わらずオシメルチニブを使えることになったら1次治療の治療選択肢は広がるだろう」と言う。
中川教授によるとこれまでタグリッソを1次治療で使用してない患者は多数おり、2次治療以降でT790M変異の有無に関わらずタグリッソを使用したいという患者会からの要望もあるという。中川教授は「そういう自由度がある程度保たれた方が良いのではないか」と述べた。
セミナーには国立がん研究センター中央病院の山本昇先端医療科長も登壇し「実臨床でビジンプロをどのような患者に使用するかはこれからだと思う。診療の現場にいる者としては新しい選択肢を上手く使えるようにしたい」と話した。
■記者会見
1.19年の活動方針発表「18年の薬価改定を是正する年」
-PhRMA在日執行委員会:パトリック・ジョンソン委員長-
米研究製薬協(PhRMA)在日執行委員会のパトリック・ジョンソン委員長(日本イーライリリー社長)は2月7日、今年の活動方針を発表する記者会見で「19年は18年の薬価改定で行われたことを是正する年だ」と位置付け、(1)費用対効果評価(HTA)(2)次期薬価制度改革(3)規制改革-の3つの領域に注力する方針を示した。
日本政府には対話を要求。HTAに関しては▼ICER(増分費用効果比)以外の要素について企業によるエビデンスの提出が認められること▼業界提案を含めた総合的な評価の枠組みのさらなる検討に向けて関係者との連携、協議が継続されること▼ICER以外の要素を考慮した総合的評価の枠組みをできるだけ早期に実現しさまざまな関係者と共にその運用に関する指針を策定すること-を求めた。
ジョンソン委員長は「日本のHTAはICERのみで評価されるので懸念している」と語る。HTAの本格導入に関する現行案は(1)世界的なHTAの専門家や患者など主要なステークホルダーの意見を取り入れずに策定した(2)質調整生存年(QALY)に基づく狭い意味でのコスト計算によって医薬品の価値が低く評価されている(3)諸外国の経験に学んでおらず世界の最新トレンドから逸脱している-といった問題点があると指摘。「我々もICER以外の要素を提示したい。アンメットメディカルニーズ、疾患の重篤度、そして医薬品の社会的な側面を評価することで、医薬品の総合的な価値が評価できると考えている」とした。
なお、次期薬価制度改革には▼新薬創出等加算の見直し(品目要件の拡充、企業要件の撤廃)▼効能追加等の革新性・有用性を評価する仕組みの導入▼再算定のあり方の見直し▼特許切れ医薬品市場の改革など持続可能性を確保するための方策-を要望した。規制改革に対しては▼薬機法改正における先駆け審査指定制度、条件付き早期承認制度の法制化と、指定対象、指定品目数などについて欧米の早期承認制度に対する競争力の確保▼RWD(リアルワールドデータ)、ICT(情報通信技術)、AI(人工知能)などの活用により開発および市販後安全性監視活動が効率的に行えるよう最適化を図ること-を求めた。
■行政トピックス
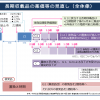
1.厚生科学審議会臨床研究部会2月15日
特定臨床研究結果の薬事承認申請への活用が論点に
厚労省は2月15日の厚生科学審議会臨床研究部会に「臨床研究・治験の推進に係る論点整理」を示した。論点として、(1)リアルワールドデータの薬事申請への活用を含め、利活用促進の観点から、CIN(クリニカル・イノベーション・ネットワーク)構想の今後の取り組みについてどう考えるか(2)臨床研究法に基づいて実施された臨床研究の結果を薬事承認申請に活用できるよう、国際的な整合性等を踏まえつつ、実施された臨床研究の内容や実施体制などに応じて、必要な要件等について検討を進めることとしてはどうか-といった製薬企業の研究開発の効率化につながる内容が盛り込まれた。3月に中間取りまとめ、夏ごろをめどに最終取りまとめを行う計画だ。
臨床研究部会では、昨年12月から今後の臨床研究や治験の活性化に係る方向性の議論に着手しており、今回が3回目。過去2回の議論では、リアルワールドデータの利活用促進について「その利活用に係る薬事承認の在り方等の具体的な運用を示しつつ、議論を進めていく必要があるのではないか」、また、特定臨床研究の結果の活用について「条件付き早期承認制度に基づき承認された品目の条件解除や、成人の効能を持っている医薬品の小児への適応拡大の申請資料に用いるなどの活用は検討できないか」といった意見が出された。
3回目の会合で厚労省医薬品審査管理課の荒木康弘課長補佐は、臨床研究法に基づく臨床研究結果の薬事承認申請への活用について「どういったものが私どもとして受け入れ可能なのかということをよく考えて、適切に方針を示していきたいと考えている」と語った。
厚労省は、03年4月に「全国治験活性化3カ年計画」を、07年3月に「新たな治験活性化5カ年計画」を、そして12年3月にこれまでの計画の集大成として「臨床研究・治験活性化5カ年計画2012」を策定し、16年度に終了。臨床研究部会は、多くの項目で達成または取り組みの進捗があったことを確認した。今後、活性化などに関する議論は臨床研究部会で行い、そこで議論したことを厚労省が実施し、部会で、それをチェックしていくという形で、PDCAサイクル(計画・実行・評価・改善)を回していく。