■行政トピックス
1.中医協薬価専門部会 3月15日
中間年改定、対象品目の選定方法で議論
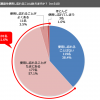
中医協薬価専門部会は3月15日、昨年末にまとまった政府の「薬価制度抜本改革基本方針」を踏まえ、個別課題の議論を継続し、この日は「(毎年改定のうち)中間年の薬価改定の在り方」をテーマに議論した。中間年は「価格乖離の大きな品目」で薬価改定を行うことになっているが、その一定率を示すことに対して、製薬業界の専門委員から「市場における価格交渉のメルクマールになってしまう」と慎重論が出た。
政府の基本方針には、毎年改定について「市場実勢価格を適時に薬価に反映して国民負担を抑制するため、全品を対象に、毎年薬価調査を行い、その結果に基づき薬価改定を行う。そのため、現在2年に1回行われている薬価調査に加え、その間の年においても、大手事業者等を対象に調査を行い、価格乖離の大きな品目について薬価改定を行う」と盛り込まれた。そして具体的なルールづくりは中医協に引き継がれた。
先月8日の薬価専門部会では、「中間年の薬価調査の在り方」についての議論が行われ、支払側から「本調査の考え方を踏襲しつつ、調査対象となる客体を単純に抽出して行えばよい」、診療側から「基本方針に則り、対象の卸売業者を絞ることで、調査客体に負担がない形で調査を行うべき」との意見が示されたところ。
3月15日の「中間年の薬価改定の在り方」の議論では、厚労省が「対象となる価格乖離の大きい品目についてどう考えるか」と問題提起。その上で、「事前に、薬価改定の対象となる具体的数値基準を示すこと・示さないことのメリット・デメリットについてどう考えるか」と問い掛けた。
吉森俊和委員(協会けんぽ理事)は「製薬企業の予見性の確保やルールの公平性の観点から、具体的な数値基準を示すことは別としても、一定の考え方があった方が望ましい」との考えを示した。専門委員の加茂谷佳明氏(塩野義製薬常務執行役員)は「具体的数値基準の示し方にもよるが、例えば、一定率という示し方になった場合、市場における価格交渉のメルクマールになってしまうことが懸念される。具体的という点については注意が必要だ」と訴えた。
また、厚労省が「仮に、同価格帯の一部の後発品が価格乖離の大きい品目として薬価改定の対象となった場合、価格帯との関係についてどう考えるか」と問い掛けたのに対しては、吉森委員が「公平性の観点から一部の品目が改定される場合には、それを含めた価格帯の価格、3価格帯なら3価格帯で薬価が見直されることが妥当ではないか」とした。
2.中医協総会 3月15日
7対1入院基本料見直しで激しい応酬
中医協は3月15日の総会で、次回18年度診療報酬改定に向けて「入院医療(その2)」をテーマに議論した。今回から「一般病棟入院基本料」の議論に着手。早速、支払側委員から「7対1がこれほど必要なのか」(幸野庄司健保連理事)との発言が飛び出すと、診療側委員は「前回の改定からまだ1年たっていない。また見直そうというのはあまりに拙速」(中川俊男日医副会長)と対抗。両側の意見がかみ合わないままに終わった。
厚労省は「一般病棟入院基本料」の論点を提示し、「入院基本料は、入院診療に係る基本的な療養に係る費用(環境、看護師等の確保、医学管理の確保等)を評価するものであるが、現行の一般病棟入院基本料は、主に看護配置等の要件で段階的に設定されており、入院医療については、患者の状態や診療の効率性等の要素も考慮する必要があるのではないか」と問題提起した。
これに対し、吉森俊和委員(協会けんぽ理事)は「方向性について賛成」とし、「7対1や10対1の部分については、実際に入院している患者の病態、『重症度、医療・看護必要度』、年齢別の疾患等についてもう少しきめ細かくていねいなデータが必要」と厚労省に求めた。
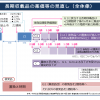
幸野委員は、「7対1が約36万床、10対1が約20万床と、7対1が圧倒的に多い」と指摘。その上で、厚労省が示した資料を基に、「7対1では高齢者の患者は少なく、現役世代が6割を占める」「今後、現役世代の人口は減少していく」「高齢者に対する医療提供密度は下がっている」との解釈を示し、「7対1の必要性がなくなってきている」との認識を示した。
さらに、同省が示した「(7対1、10対1)届出医療機関別の『重症度、医療・看護必要度』と平均在院日数の分布」の資料を踏まえ、「例えば重症該当患者割合が同じところにある7対1と10対1でも、10対1の方が、平均在院日数が短かったり、ばらけたりしている」と指摘し、「本来10対1にいてもいい患者が7対1に入院しているのではないか。7対1と10対1の入院基本料が相当違うにもかかわらず、中身についてはあまり差別化されていないのではないか」と懸念を示した。
前回16年度改定では、「重症度、医療・看護必要度」の評価表を抜本的に見直し(A項目・B項目のメニューの見直し、C項目の新設)たり、7対1の重症患者割合を15%から25%に引き上げたりしたが、幸野委員は「ABC項目が正しかったのか、25%という数値が妥当なのか見直していく必要がある。また、7対1や10対1の医療密度がどうなっているかという指標を入れていくべき」と訴えた。
これに対して、中川委員は「過去2回の改定で『重症、医療・看護必要度』を見直し、そのたびに大混乱を来たしたが、少しずつ病院が体制を整えつつある状況で、ABC項目がいいのかも含めてまた見直すべきだという意見は全く受け入れられない」と強く反発した。
■記者会見
1.ジプレキサの減を効追品でカバー
-日本イーライリリー:ジョンソン社長-
日本イーライリリーは3月15日に都内で記者会見を開き、2016年度の業績と17年以降の成長戦略を説明した。16年度はセロトニン・ノルアドレナリン再取り込み阻害剤サインバルタ、抗がん剤サイラムザなどの主力品が適応拡大を受けて伸長し、売上高は2432億円(対前年比3.1%増)であった。パトリック・ジョンソン社長は、同社としてマイナス約5%の薬価改定と抗精神病薬ジプレキサ、骨粗鬆症治療剤エビスタへの後発品参入があったにもかかわらず成長を遂げたことを強調した。17年度以降の業績のけん引役としては、16年度に伸長した製品に加え、現在申請中の関節リウマチ(RA)治療薬バリシチニブ、第3相の抗がん剤アベマシクリブを挙げた。
サインバルタは16年に慢性腰痛症に伴う疼痛、変形性関節症に伴う疼痛が適応追加され、売上高は対前年比36.6%増の416億円(薬価ベース、以下同)となった。サイラムザも16年に大腸がん、非小細胞肺がんの適応追加があり、314.2%増の289億円を売り上げた。ジプレキサは22.1%減の477億円、エビスタは35.1%減の131億円だった。
研究開発本部担当の藤本利夫副社長は、革新的な医薬品を世界同時開発し、14年から23年までに20製品の承認を目指しているとした(すでに国内では5製品を上市)。重点領域は神経変性疾患、糖尿病、がん、自己免疫疾患、疼痛で、JAK1/2阻害薬のバリシチニブはRAに対して申請中。CDK4/6阻害薬のアベマシクリブは乳がん、非小細胞肺がんで第3相が進行している。
神経変性疾患では、アミロイドβ(Aβ)を標的とした認知症薬の開発は今後も続けるとし、脳に蓄積したAβを除去する抗N3pG-Aβ抗体の有望な知見を紹介。国際共同第3相試験で主要評価項目を達成できなかった抗Aβ抗体ソラネズマブは、アカデミアとの共同研究は継続するという。タウを標的とした薬剤も開発中と述べた。
■記者会見
2.AD治療薬開発「順調に進んでいる」
-エーザイ:内藤晴夫CEO-
エーザイの内藤晴夫CEOは3月9日、都内で開催された記者懇談会で同社のアルツハイマー型認知症(AD)治療薬の後期開発品目について「順調に進んでいると理解している」と語った。リリーの抗アミロイドβ(Aβ)抗体ソラネズマブは軽度ADを対象とした第3相EXPEDITION3試験で主要評価項目を達成せず、メルクはBACE阻害剤ベルベセスタットの軽度および中等度ADを対象とした第2/3相EPOCH試験を中止した。他社から開発失敗が伝えられる中でエーザイのAD治療薬の開発状況が注目されていた。
エーザイのパイプラインを見ると、早期AD患者を対象としていることが特徴。診断がつく前の1~2年の段階をプロドローマルAD、診断がついた後は軽度、中等度、重度とあり、エーザイの言う早期ADはプロドローマルから早期の軽度ADを指す。BACE阻害剤エレンベセスタットはバイオジェンと共同で早期ADを対象とした第3相MISSION AD1、MISSION AD2試験を進めている。抗Aβ抗体アデュカヌマブはバイオジェンが早期ADを対象とした第3相ENGAGE試験とEMERGE試験を進めており、エーザイは共同開発・共同販促のオプション権を保有している状況。また、抗Aβ抗体BAN2401はバイオジェンと共同で早期ADを対象とした第2相を行っている。
内藤CEOは会見でBACE阻害剤と抗Aβ抗体について他社を含めた試験デザインの一覧を提示し「ADと診断された人の3分の1にはAβの沈着がないということも知られているので、Aβの確認は患者選定に必須となる」、「エンドポイントにプロドローマルに対して感度が良いといわれているCDR-SBを用いているものと認知症の指標となるADAS-Cogを使用しているものがある」と試験デザインの違いを指摘した。試験結果は待つしかないが、少なくともバイオジェンおよびエーザイの試験デザインが 1.適切な対象(早期AD)患者を選定しアミロイド沈着を確認していること 2.用量設定の留意 3.早期ADの臨床評価に感度のあるエンドポイントを選択 4.同一デザインの2本の検証試験を同時進行するなど「AD疾患修飾剤の臨床開発の成功ファクター」を押さえたものであることを強調した。
なお、イーライリリーのEXPEDITION3試験はソラネズマブ投与群がプラセボ群と比較して主要評価項目のADAS-Cogで測定した進行抑制は11%(p=0.095)であり、統計学的に有意な進行抑制は見られなかったが、副次評価項目のCDR-SBで測定した機能低下の進行抑制は15%(p=0.004)で有意差が出ている。メルクのEPOCH試験は組み入れ条件にアミロイド陽性を入れてなかったが、組み入れ条件にアミロイド陽性を入れたべルべセスタットのプロドローマルAD対象の第3相APECS試験は続いている。
早期ADの進行抑制だけでなくADの治癒に向けて内藤CEOはAD治療薬開発の3つの軸にも言及。エーザイではAβ→タウ→反応性グリア細胞という攻撃因子の重積過程に対するアプローチのほか、睡眠障害→行動障害→認知障害の経時的症状変容に対する治療薬開発を進めている。加えて、第3の軸として脳の維持システムに着目した防御機構へのアプローチがあるとして、防御機構強化による脳内クリアランス促進薬、アストロサイト(中枢神経系にあるグリア細胞)を標的とした脳内恒常性改善薬、神経幹細胞賦活薬というアイデアについて「アカデミアとの共同作業が始まろうとしている段階」と話した。
■セミナー便り
1.キイトルーダ、免疫関連副作用に注意を
-京都府立医大呼吸器内科学:高山浩一教授-
京都府立医科大学大学院医学研究科呼吸器内科学の高山浩一教授は3月13日、MSD主催「抗PD-1抗体キイトルーダ発売記者説明会」で講演し、非小細胞肺がん1次治療の承認根拠となった国際共同第3相試験「KEYNOTE-024試験」のデータを基に、その有効性について「無増悪生存期間(PFS)を延ばし、かつ全生存期間(OS)を延ばすという極めて大きなインパクトを与えた」と指摘した。一方、安全性については、免疫関連の副作用に注意すべきと述べた。
「KEYNOTE-024試験」は、化学療法未治療の非小細胞肺がん(1次治療)患者で、PD-L1発現率50%以上を対象に実施。登録された305例(キイトルーダ群154例、化学療法群151例)中、日本人患者も40例含まれていた。主要評価項目はPFS、副次評価項目はOSおよび奏功(ORR)、安全性だった。
それによると、PFSのハザード比は0.5。高山教授は「キイトルーダ群の方が、病気の進行するスピードを半分に落としたということ。実臨床で効いているという感覚を得られるのがハザード比0.8ぐらいなので、0.5というのは極めて大きな差」と説明。また、OSのハザード比は0.6。「患者が亡くなるスピードを40%遅くしている。免疫チェックポイント阻害剤を先に使った方が、全体の生存期間を延ばすことを初めて証明し、極めて大きなインパクトを与えた」とした。
一方、安全性では、免疫関連の副作用に特に注意すべきとし、「そのプロファイルはニボルマブとほぼ同じ。活性化したリンパ球ががん細胞を攻撃してくれたらいいのだが、間違えて正常細胞を攻撃してしまうことから、いわゆる自己免疫疾患に似たような状況が人工的につくられてしまう恐れがある」と解説した。
実際、「KEYNOTE-024試験」では、免疫関連副作用として、キイトルーダ群で甲状腺機能低下症が14 例(9.1%)、甲状腺機能亢進症が12 例(7.8%)発現しており、「10人に1人くらいは甲状腺に何か起こるということを覚悟しておかないといけない」とした。このほか、肺炎9例(5.8%)、重篤な皮膚障害6例(3.9%)、大腸炎3例(1.9%)などとなっている。
このように様々な副作用が起こる可能性があることから、「本当にこの薬の副作用なのか、病気そのもので起こっている障害なのか、全然違う別の病気が起こったのか、見極めが非常に大事。それぞれの専門家とネットワークを組んで副作用に対応する必要がある」と述べた。
また、こうした免疫関連副作用の発現時期の目安はつけにくく、「従来の抗がん剤や分子標的薬はおおむね副作用が起こるタイミングが分かっていたのに対し、免疫チェックポイント阻害剤で一番やっかいなのは、副作用がいつ起こるか分からないこと」と指摘。「逆に言えば、患者さん自身に非常に注意してもらわないといけない。患者教育が非常に重要な薬といえる」と述べた。
■セミナー便り
2.短期的視座のみに立った政策はイノベーションを阻害する
-米国バイオテクノロジー産業協会:ジェームズ・グリーンウッドCEO
3月14-15日に米国バイオテクノロジー産業協会(BIO)が主催するパートナリングイベントであるBio Asia International Conferenceが都内で開催された。冒頭、BIOの会長兼CEOであるジェームズ・グリーンウッド氏が挨拶した。
同氏は、バイオ産業に必要なものは優秀な研究者、リスクを取る覚悟がある投資家、そして産業育成を支える制度および公的セクターの3つの要素に集約されるとした上で「日本はそれらのものを米国と同じように十分に備えている。しかし、これが現在危機を迎えようとしている」とし、医療費抑制策に基づく薬価制度の変革、さらには毎年改定への動きを問題視する。「毎年改定は確かに一時的には有効な薬価抑制策であるように見えるかもしれない。しかし短期的な視座のみに立った政策を採用した結果、投資家の投資意欲が削がれ、イノベーションの発展を阻害するかもしれない。忘れてはならないのは、治療を受けながらも奏功せず死んでいった患者が、イノベーションによって健康寿命を全うする可能性がある。イノベーションが、日本の患者に迅速に新薬を届けることにつながるのである。日本政府には、長期的視座に立って、賢明な政策判断を行ってもらいたい」と訴えた。
続いて開会演説では厚生労働大臣政務官である馬場成志氏が講演。「日本のアカデミアの水準は世界に引けを取らず、また、製造業は優れている。しかし、こういう高い技術や素養がありながら、医薬品としては十分に成功できているとは言えない。これはつなぎ役としてのベンチャー企業がないからだ」として当局としてもベンチャーの積極的な育成が必要であるとの認識を示した。
そして、ベンチャー振興に当たっての日本の強みと弱みについて次のように指摘した。まず強みとしては以下の4点を挙げた。 1.大学や研究機関の有するシーズが高い水準にあること 2.欧米と異なり、病院での臨床試験が一般的に行われていること。全国に病院が展開しているため臨床試験を幅広く行うことができている。これを生かせるのではないか 3.伝統的に優れたモノづくり技術があること。これを医薬品の開発にも生かせるのではないか 4.承認審査プロセスの迅速化が進んでいる。特に再生医療分野で法整備が進んでいる。
一方で、弱みとしては以下の5点を挙げた。 1.人材の移動が活発ではないため、起業家が少ないこと。人材の確保が困難であること 2.ベンチャー企業への投資額が少ないこと。米国に比べ数十分の一程度しかなく、公的な資金の供給も少ない 3.海外との人的・資金的なつながりが弱いこと。これはインバウンド・アウトバウンド両方に言えることである 4.医療に関する制度や規制が、大企業を前提としているために、ベンチャー企業がビジネスをする上では困難に直面する場面が多いこと 5.ベンチャー企業としての成功例・成功体験・モデルケースに乏しいこと。
これらの弱みを克服できれば、ポテンシャルは大きいのではないかとの見方を示す一方、当局としては、これまでもベンチャー企業の振興策を様々に行っては来ていたものの、目立った成果が無いことが問題とし、「振興策の枠組みにはもっと根本的な、大胆かつ積極的なパラダイムシフトが必要となる」と考えを示し、今後のベンチャー振興策として以下の3つの原則を掲げた。
1)規制から育成へ
日本の医薬品産業を成熟させるためには規制は必要なものだったが、主に大手を想定したものであった側面もある。不必要な規制はベンチャー振興をさまたげかねず、その観点からも規制の最適化が必要であると考えている。
2)慎重からスピードへ
ベンチャービジネスはハイリスクで、スピーディな判断が肝である。何事にも慎重を期するようでは成長の芽を摘んでしまいかねない。
3)マクロからミクロへ
これまでのように、大手を想定して、すべての企業を一律に扱うような制度は様々な特徴を備えているベンチャーのニーズにはこたえているとは言えない。それぞれのベンチャーの特徴を生かせるようなきめ細かい制度が必要である。
さらに、このようなベンチャー企業の育成のためには、そのためのエコシステムの醸成が必要となってくる。その取り組みを以下の3つの柱にまとめた。
1)エコシステムを醸成する制度
革新的な医薬品などは薬事上の優遇策が必要であり、そのような制度面からのサポートに積極的に取り組む。
2)エコシステムを構成する人材づくり
人材の育成は極めて重要である。人材の流動化やベンチャーの幹部と製薬企業の幹部とのマッチングなども進めてゆく。
3)オール厚生労働省での進行体制
厚生労働省が全体としてベンチャー支援の組織体制を整備する。その例として「ベンチャー等支援戦略室」を新たに設置した。
このように、政府が日本のベンチャー振興の弱みを把握し、バイオベンチャー育成の重要性を認識し、本格的に取り組み始めたことは、今後の大きな追い風となるだろう。ただ、一方で、米国でバイオベンチャー産業が栄えているのは政府による支援があったからではなく、むしろそのような政府による干渉がない自由な風土と競争環境、そして人材の流動化によるところもあったのではないか。保険制度やベンチャー精神文化の違いはあろうが、国際競争力の高いバイオベンチャー産業が栄えるためには、政府による、いわば人工的な環境づくりの一方で、自由な風土の下で自立飛行へと離陸させることも求められよう。