■行政トピックス
1.医薬品医療機器制度部会 4月11日
MRの情報提供活動を改善、GL策定へ
MRによる口頭説明や書類を配布しないスライド説明など証拠を残さないことを企図した手法や、事実誤認の誘発を狙った説明ぶりなど、不適切な広告活動の巧妙化が散見される―。
厚労省は、実施中の「医療用医薬品の広告活動監視モニター事業」で浮き彫りになったこうした課題を踏まえ、新たに「医療用医薬品の販売情報提供活動に関するガイドライン」を策定して、対策に乗り出すことを4月11日の厚生科学審議会医薬品医療機器制度部会で説明した。
厚労省が実施中の広告活動監視モニター事業は、全国の医療機関の中から選定した覆面のモニター医療機関が、MR、MSL等による広告・宣伝活動について問題のありそうな事例を厚労省に報告するもの。
同省によると、16年度には3カ月間の調査実施期間中に、モニター医療機関から39の医薬品等について適切性に関する疑義報告があり、違反が疑われる項目は64件に上った。
厚労省は昨年11月の前回会合で、このうち(1)MRによる高リン血症治療薬の口頭説明で、自社製品に特有な副作用を効能効果としてPRした事例 (2)医療関係者向け情報提供サイトでの抗リウマチ薬の企業配信動画で、指定外の初期投与量を推奨およびデータの比較において強調を行った事例 (3)MRによる統合失調症治療薬のプレゼンテーション(口頭説明・スライド)で、他の医薬品との差別化のために、臨床データのない効能効果を紹介した事例 (4)製薬企業が主催する気管支拡張剤のWebセミナーの図表で、グラフの縦軸の間隔を伸ばすことで効果を誇張した事例―を説明。
今回、新たに17年度の同モニター事業の中間報告を行った。それによると、調査実施期間中(5カ月)の2カ月において、23の医薬品等について適切性に関する疑義報告があり、違反が疑われる項目は30件だった。
厚労省は、このうち (1)MRによる便秘関連症治療薬の口頭説明で、承認範囲を逸脱する効能効果を積極的に紹介した事例 (2)MRによるホルモン剤の口頭説明で、自費診療で査定がないことを理由に承認外の投与方法を紹介した事例 (3)抗がん剤の製品情報概要で、非盲検期を含めたデータを盲検期のデータに加工し対照群との差を誇大に見せた事例 (4)MRによる抗がん剤のプレゼンテーション(スライド・口頭説明)で、恣意的な補助線と説明文により、対照群との差を誇大に見せた事例 (5)MRによる消化薬の口頭説明で、データを示すことなく半量投与の効能効果を保証した事例 (6)MRによる造影剤のプレゼンテーション(スライド・口頭説明)で、施設における他社製品との比較データをもとに安全性をPRし、他社製品をひぼうした事例 (7)MRによる抗ウイルス剤のプレゼンテーション(スライド・口頭説明)で、RMP記載のリスクを認識せずにプロモーションを行った事例―を示した。
これらを踏まえ、厚労省は、課題として、(1)証拠が残りにくい口頭説明やパソコン映像のみで不適切な説明を行う事例への対応 (2)明確な虚偽誇大とまでは言えないが、不適正使用を助長すると考えられる事例への対応 (3)ブログなど第三者を装って行っていて、広告該当性の判断が難しい事例への対応―を挙げた。その上で、米国やフランスにあるGLを参考に、厚労省としてGLを策定する方針を明示。
加えて、「未承認薬、適応外薬の広告は薬機法68条において禁止されているが、医療関係者や患者が求める情報に関して、本当に広告に該当するものかどうなのか。広告に該当しない場合、どのようなやり方が最も適切か一定の考え方を整理したい」(磯部総一郎監視指導・麻薬対策課長)として、米国にあるGLを参考に、厚労省として、オフラベルに関する情報提供GLを整備する考えを明らかにした。
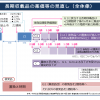
厚労省の「医療用医薬品の販売情報提供活動に関するGL」の項目案
【基本的考え方】適用範囲等▽情報提供活動の原則
【医薬品製造販売業者の責務】経営者の責任▽社内体制の整備▽資材・情報提供活動の適切性の確保▽評価・教育等の取り組み▽監督の実施▽記録の作成・管理▽問題が生じた時の対応▽業務委託等
【販売情報提供活動に携わる者の責務】ガイドライン等の順守▽自己研鑽の努力▽情報提供活動の際の留意点▽不適切な資料の使用禁止
【その他】GLに記載のないことへの対応▽業界のおける対応▽情報提供の求め等への対応▽他の法令等への対応
■記者会見
1.イノベーションへの支援を要望
-PhRMA:ロバート・A・ブラッドウェイ会長-
米国研究製薬工業協会(PhRMA)のロバート・A・ブラッドウェイ会長(米アムジェン会長兼CEO)は4月12日の来日記者会見で薬価制度の抜本改革に関し「我々製薬業界のリーダーたちは懸念を高めている。革新的新薬が日本市場で報われるのか不透明になってきた。非常に厳しいので、我々は決断しなければいけないのかもしれない」と述べた。
これまで厚労省やPMDAなどの努力によりドラッグラグが解消されてきたが、薬価制度の抜本改革はそれとは違うイノベーションを阻害するものと指摘し、場合によってはドラッグラグが再び起こると示唆した。
がん領域で分子標的薬、免疫チェックポイント阻害剤など革新的な新薬が普及したほか、CART細胞療法や遺伝子編集技術(CRISPER)など革新的な技術が登場してきた状況についてブラッドウェイ会長は「非常にエキサイティングな時代だ」と評価した上で「イノベーションにどう報いていくのか。薬価制度に関して工夫していく必要があるだろう」とした。
日本政府に対して「イノベーションをサポートする姿勢をしっかり見せてほしい」と要望。(1)新薬創出等加算の対象品目絞り込み (2)費用対効果評価の導入 (3)薬価調査と改定の毎年実施―に反対し、「アンメットメディカルニーズに対応していくことが重要であり、政府は、イノベーションをサポートすることから後退するのではなく、我々の共通の敵である疾患に立ち向かっていくためにイノベーションを推進し、高度化していくことが何よりも重要だ」と強調した。
一方で国民皆保険を維持するためのコスト削減に関しては「米国では処方せんの9割が後発品という形で処方されている。後発品を増やす余地はあると思う。革新的な治療法を開発していくには長期収載品に割かれていたリソースを開放していくことが大事だ」と述べた。
少子高齢化が進む中で「我々が先手を打って社会の高齢化に対応していかなければ、いまから革新的な医薬品を開発して、高齢者の疾患のいまの軌跡を変えていかなければ、財政はどんどん悪化すると思う。薬剤費が悪者と考えられていれば、財政は改善しない。入院費や医療にかかる費用は他にもある」とした。
抗PCSK9抗体で心不全や脳卒中を未然に防ぐことができたり、アルツハイマー型認知症治療薬によりADの進行を抑制できれば、その分、入院や介護にかかる社会的コストが軽減できる。イノベーションによる社会的コストの低減というものにも目を向ける必要性を強調した。
■記者会見
2.共通のSMFテンプレート使用で産官合意
-第7回アジア製薬団体連携会議-
「アジアにおける創薬エコシステムの創製を目指して」をテーマとする第7回アジア製薬団体連携会議(APAC)が4月10日に都内で開催され、11日に記者会見が行われた。創薬エコシステムとは、アカデミア、ベンチャー、製薬企業および行政が創薬に関与するプレーヤーとしての役割を好循環を持って果たし、その結果として、医薬品が持続的に創製される状態を表している。
会議は規制・許認可、新薬アクセス、創薬連携の3つのセッションに分けて実施された。規制・許認可セッションでは、昨年日本で開始した条件付き早期承認制度を初めて取り上げ、同制度により承認を受けた医薬品をアジアで展開する際に想定される課題について議論した。
その結果、医薬品の早期アクセスに有効かつ効果的な制度であることが合意されるとともに、制度のコンバージェンス(共通化、ハーモナイズ)が無い状況では、多くの地域での開発および他の国への展開の際には問題が生じる可能性があることが確認された。
新薬アクセスセッションでは、昨年の同セッションでSMF(サイトマスターファイル:医薬品製造所が作成する、医薬品製造に関する品質管理マネジメントの方針、プロセス等に関する情報をまとめた書類)の共有化が提案されたことを受け、この1年間で日本のPMDAのテンプレートをベースに各国の意見を集めて共通のテンプレートを作成する作業が進められた。
今回のセッションでは各当局と産業界が共にAPACの提唱するSMFテンプレートを使うことに合意し、SMFの標準化が前進した。
今年度は承認取得後の変更管理も議題に取り上げられた。日米欧などで先行して承認された医薬品について、追加で実施される製法の改良、製造場所の変更等が行われた場合、変更によって更なる安定供給と高品質の製法が確立されたとしても、アジアの一定の当局では認められない、あるいは特別の追加試験を要求され、「革新的な医薬品をアジアの人々に速やかに届ける」のミッション実現の妨げになっている。
そこでまずは、約30社へのアンケートを通じて課題を抽出、承認取得後の変更申請時におけるCMCや安全性データに関する各国の違いを明確にした。
創薬連携セッションでは、天然物の創薬応用をサポートするガイドラインの作成作業が昨年から進められた。今年度はパイロットプロジェクトをスタートさせる予定だ。まずは天然物ライブラリを作成しているタイでスクリーニングを行う計画で、これに先立ってタイの研究者を日本の製薬企業に派遣して人材育成を図る。
APACはアジアにおける研究開発型の製薬団体が各国政府関係者やアカデミアを交えて課題認識を共有し、改善に向けた提言などを行う目的で2012年より開始された国際会議だ。今回から中国の研究開発型製薬団体であるPhIRDAが正式メンバーとして初めて参加し、加盟団体は13となった。
PhIRDAのエグゼクティブプレジデントを務める宋瑞霖氏は会見で、「中国、日本、韓国ほかのAPACメンバーが手を携えれば米国を超えることもできる」と述べた。
■セミナー便り
1.肺がん免疫療法3剤を使い分け
-国立がん研究センター中央病院:大江裕一郎副院長-
国立がん研究センター中央病院の大江裕一郎副院長(呼吸器内科長)は4月12日に開かれた中外製薬のメディア・投資家向け説明会で、非小細胞肺がん(NSCLC)の免疫療法薬の使い分けについてコメントした。NSCLCに対しては、同社の抗PD-L1抗体薬テセントリク(アテゾリズマブ)が今年1月に承認されて計3剤となったが、治療ライン、腫瘍のPD-L1発現状況、組織型、投与頻度を考慮して使い分けるとした。
具体的には、Ⅳ期の患者の1次治療でPD-L1の発現率が50%以上(強陽性)であれば、抗PD-1抗体薬キイトルーダ(ペムブロリズマブ)とする。これは標準的な治療だという。
一方、「コンセンサスはない」と前置きしつつ、2次治療でPD-L1が50%未満の場合、組織型が扁平上皮がんなら抗PD-1抗体薬オプジーボ(ニボルマブ)を用いるとした。ドセタキセル(DTX)を対照とした臨床試験で全生存期間(OS)延長のハザード比が低いことが魅力だという。PD-L1が陰性かつ非扁平上皮がんの場合はオプジーボかテセントリクを用いるとした。ただ、オプジーボは非扁平上皮がんの臨床試験で「開始当初、生存曲線がDTXをやや下回るのが気持ち悪い」と指摘。テセントリクの国際共同第3相試験「OAK試験」ではそのようなことはないのが長所だとした。また、投与頻度がオプジーボは2週間に1回だが、テセントリクは3週間に1回であり、患者にも医療者にも都合がよいと評価した。同剤は1回1200㎎の固定用量で、「体重から計算する必要がない」ことも歓迎した。
同剤は肺がん領域では初めての抗PD-L1抗体薬。OAK試験では、PD-L1発現状況を問わない有効性解析集団(n=850)でDTXに対して有意にOSを延長した。PD-L1陰性群でもDTXに対してOSを延長しており、適応にPD-L1発現に関する縛りはない。副作用について大江氏は「抗PD-1抗体薬とほとんど同じプロファイルだと思う」と述べた。
■セミナー便り
2.統合失調症、LAIによる再発防止に期待
-藤田保健衛生大学医学部:岩田仲生教授-
藤田保健衛生大学医学部精神神経科学講座の岩田仲生教授は4月5日、大塚製薬主催のエビリファイの持続性注射剤(LAI)に関するメディアセミナーで講演し、LAIの統合失調症の再発・再入院予防効果に期待を示した。岩田教授によると、薬物治療を中止した場合の初回の再発リスクは服薬を維持した場合の約5倍となっている。再発リスクは、抗精神病薬の維持管理によって減少する。ただし1日1回あるいは2回の服薬を毎日続けることは難しい。良好なアドヒアランスを維持するためには4週に1回投与のLAIという治療選択肢もある。岩田教授は「飲まないと再発してしまうのに飲まなくなってしまう。そういう人にはLAIを勧めるべきではないか。月に1回、外来に来てくれれば、そこで注射を打てるので、これは患者にとってメリットになる」とした。
現在、大塚製薬はエビリファイLAIについて1000人を超える規模の大規模調査(市販後調査)を行っている。調査にかかわる岩田教授は「LAI導入前後で入院回数・入院日数が減少していることや、前治療薬に比べて患者自身の治療満足度/QOLが良いことが出てきている。おそらく6月には報告できるかと思う」と話した。
なお、米国ではエビリファイのデジタルメディスンが上市されている。錠剤の中にチップが入っており、胃酸と反応するとシグナルが出る。腹部に貼ったパッチがこのシグナルを検出し、スマートフォンやタブレットといったデジタルデバイスに送信し、服薬状況の管理ができる。デジタルメディスンもまた再発・再入院の防止に役立つ剤形であるが、国内では研究レベルにとどまっているという。
■セミナー便り
3.ALL治療薬ベスポンサに高い期待
-東京慈恵会医科大学:薄井紀子教授-
4月9日、東京慈恵会医科大学腫瘍・血液内科の薄井紀子教授はファイザー主催の再発または難治性のCD22陽性の急性リンパ性白血病(ALL)治療薬ベスポンサ(一般名:イノツズマブ オゾガマイシン)に関するプレスカンファレンスで講演し、「国際共同第3相試験で有用性を示したベスポンサには高い期待を寄せている」と述べた。
ALLの治療は、フィラデルフィア(Ph)染色体陽性の場合はイマチニブ併用の化学療法による寛解導入療法を行い、Ph陰性の場合は若年者と非若年者に分けて化学療法による寛解導入療法を行う。寛解導入療法およびその後の地固め療法(寛解後療法)によって治癒するのは2~3割程度であると、同じく講演した慶應義塾大学医学部血液内科の岡本真一郎教授は解説した。残りは再発するか、治療抵抗性(難治性)を示す。
薄井氏によれば、再発・難治性ALLの治療もPh染色体の有無で異なる。陽性患者には第2世代、第3世代のTKI(チロシンキナーゼ阻害剤)を使い(イマチニブは第1世代TKI)、陰性患者には前治療歴と再発までの期間を考慮して薬剤が選択される。症例によっては治験への参加も選択肢の1つであり、標準的治療法は確立しておらず、試行錯誤しているのが現実という。予後については、スペインのデータでは再発ALLの生存期間中央値は1年に満たず、英国や欧州でのデータでは5年OS(全生存期間)が7%と示されるなど非常に悪く、改善のためには「ALL細胞が有する分子を標的とした新規薬剤の導入が望まれる」と語った。
ベスポンサは1月19日に承認を取得した(4月18日に薬価収載された)。CD22を標的とするモノクローナル抗体に細胞傷害性化合物カリケアマイシンを繋いだ抗体薬物複合体である。ALLのうち8~9割がCD22を発現する。
国際共同第3相INO-VATE試験では、日本人を含む再発・難治性のCD22陽性ALLの成人患者326人を登録し218人で有効性を評価した。標準的とされる化学療法群との比較で、血液学的完全寛解率は標準化学療法群29.4%に対してベスポンサ群は80.7%が達成し、しかもそのうち、9割を超える患者が2サイクル以内で血液学的完全寛解に入ることができたという成績だった。血液学的完全寛解とは、国立がん研究センターのがん情報サービスによれば、骨髄中の白血病細胞が顕微鏡検査では目で見た限りはなくなり、同時に血液検査で白血球、赤血球、血小板の数が正常な範囲内にある状態をいう。そしてベスポンサ群では43.3%、化学療法群では11.1%が造血幹細胞移植をすることができた。血液学的完全寛解を達成した後のOS率は、造血幹細胞移植の施行患者で42.0%、非施行患者で19.6%であり、やはりOS率は移植した患者群の方が高い。薄井氏は同試験について、組み入れ患者数の多さや一般的な治療法である化学療法との前向き比較試験である点を挙げてエビデンスレベルが高いと評価した。
一方の安全性では、グレード3以上のVOD/SOS(肝中心静脈閉塞症/類洞閉塞症候群)が全体で9.8%、日本人では23.1% に認められた。VOD/SOSは重症の場合は多臓器不全を合併して高率で死亡に至る。薄井氏は日本人患者に高く出ている点については要注意だとしつつ、うまくマネジメントすることで一人でも多くの患者を治していきたいと語った。
ファイザーにとってベスポンサは慢性骨髄性白血病治療薬ボシュリフ、急性骨髄性白血病治療薬マイロターグに続く3剤目の血液がん治療薬となる。同社は昨年6月にオンコロジー部門に血液がん専門の営業部隊を設置し、少数精鋭で専門医への情報提供を行っている。