■記者会見
1.骨太方針2019「我々の考えとおおむね一致」-製薬協:中山讓治会長-
■セミナー便り
1.アーリーダ「QOLを保ちながら転移を抑制」-横浜市立大学附属市民総合医療センター:上村博司診療教授-
■行政トピックス
1.薬食審医薬品安全対策調査会 6月26日 フェブリク、現時点で適用患者限定措置は必要なし
■記者会見
1.骨太方針2019「我々の考えとおおむね一致」
-製薬協:中山讓治会長-
製薬協の中山讓治会長(第一三共会長)は6月26日の記者会見で、21日に閣議決定した骨太方針2019について「記載内容は官民対話などでの議論も含まれており、我々の考えとおおむね一致している」と評価した。一方、研究開発支援体制を整えても「支援策と評価がバランスしないと産業は育たない」として、イノベーション創出に向けた環境整備と薬価制度におけるイノベーションの適切な評価とが両輪で推進されるよう求めた。
製薬協は20年度の薬価制度改革で(1)新薬創出等加算の改善(2)新薬の加算体系の再編(3)類似薬選定の基準見直し-を求める。類似薬選定の基準見直しでは従来の4つの基準(効能・効果、薬理作用、組成・構造、投与形態)に、医療実態の類似性を加え、総合的に勘案できる仕組みに見直すよう求めている。中山会長は「原価計算方式は企業の取引形態によってなかなか全てを開示できないケースがある。それを踏まえれば、比較薬の概念を広めにして、より適切な評価をする道筋の方が良い」と語った。
類似薬選定の基準見直しによって、日本発で世界初承認の革新的新薬に関して、外国平均価格調整や輸入価格に縛られない算定を可能としている他、がん種を特定しない効能を有する抗がん剤に関して同一がん種内で類似薬を選定するルールに縛られることなしにがん種を超えてより適切な類似薬を選定できるようになるとした。
また、今回の会見では、イノベーション創出に向けた環境整備での具体的な提案として、(1)がんゲノム情報管理センター(C-CAT)と連携したがんゲノム情報と臨床情報などの創薬研究への活用(2)患者のゲノム情報と臨床情報などを統合したデータベースの構築と創薬研究への活用(3)東北メディカル・メガバンク機構と連携した疾患発症過程データベースの構築と創薬研究への活用(4)アルツハイマー型認知症の発症過程の解析と予防的介入試験-など8つの取り組みを発表した。
中山会長は、これら取り組みについてAMEDのPPP(産学官連携パートナーシップ)事業として推進されることを要望し、それに向け必要な政策としてAMED組織の強化と、AMEDが数年にわたり機動的に使用できる予算の手当て・拡充を求めた。
■セミナー便り
1.アーリーダ「QOLを保ちながら転移を抑制」
-横浜市立大学附属市民総合医療センター:上村博司診療教授-
横浜市立大学附属市民総合医療センター泌尿器・腎移植科の上村博司診療教授は6月19日、ヤンセンファーマ主催の遠隔転移を有しない去勢抵抗性前立腺がん(M0 CRPC)の適応で承認された経口アンドロゲン受容体拮抗薬アーリーダ(一般名アパルタミド)に関するメディアセミナーで、同剤の特長について「無転移生存期間(MFS)を大幅に延長し、臨床症状の悪化を遅らせるなど、QOLを保ちながら転移を抑制する」と紹介した。
前立腺特異抗原(PSA)倍加時間が10カ月以下のM0 CRPC患者を対象にアンドロゲン除去療法(ADT)の併用下でアーリーダとプラセボを比較した国際共同第3相SPARTAN試験において、アーリーダはプラセボに対し主要評価項目のMFSを統計学的に有意に延長した(HR=0.297、95%信頼区間0.244~0.362、p<0.0001)。加えて、副次評価項目の臨床症状が悪化するまでの期間もプラセボに対して統計学的有意に延長した(HR=0.447、95%信頼区間0.315~0.634、p<0.0001)。上村教授は臨床症状が悪化するまでの期間のデータに関して「全身状態(PS)の良いM0 CRPCだからこそ、QOL維持ができていることは重要。エンザルタミドの試験では検証されておらず、臨床的にも意義がある」とした。
上村教授によると、M0 CRPC患者の中には死亡や転移のリスクが高い患者が存在し、「PSA倍加時間が10カ月以下の患者がハイリスクである」と解説。こうした患者において転移までの期間を可能な限り延長することがM0 CRPCの治療のポイントだとした。
横浜市大関連21施設における前立腺がんの年間の新規患者数は2011年に2069人で、そのうち限局がんは70.3%、局所浸潤がんは15.9%、転移がんは13.8%(リンパ節4.3%、骨9.5%)。上村教授は「これは全国的にも同じような傾向だ」とした。
■行政トピックス
1.薬食審医薬品安全対策調査会 6月26日
フェブリク、現時点で適用患者限定措置は必要なし
薬食審医薬品安全対策調査会は6月26日、痛風・高尿酸血症治療薬フェブリク錠(一般名:フェブキソスタット)の安全対策について審議し、米FDAと同等の対応を取らないことを決めた。米国では、製造販売後臨床試験(CARES試験)の結果を踏まえ、添付文書の黒枠警告で心血管死について注意喚起するとともに、アロプリノールによる治療が効果不十分または忍容性がない患者にフェブキソスタットの使用を限定する措置が取られており、安全対策調査会の判断が注目された。
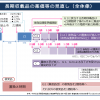
CARES試験は、心血管疾患を合併する痛風患者(目標症例数各群3750例、計7500例)を対象にフェブキソスタットとアロプリノールの心血管アウトカムを比較することを目的に実施された(10年4月~17年5月)。米国でフェブキソスタットは09年2月に承認されているが、FDAは心血管イベントの発生割合が対照群(プラセボまたはアロプリノール)と比較して高い傾向が示唆されたことを重く見て、同試験の実施を指示したもの。
主要評価項目は心血管死、非致死性心筋梗塞、非致死性脳卒中、不安定狭心症に対する緊急血行再建術の4つの因子から成る複合エンドポイント。その結果、主要評価項目に関しては、アロプリノール群に対する非劣性(HR=1.03、95%信頼区間0.87~1.23、p=0.66)が示されたものの、心血管死(HR=1.34、95%信頼区間1.03~1.73、p=0.03)および全死亡(HR=1.22、95%信頼区間1.01~1.47、p=0.04)の発現についてはフェブキソスタット群が有意に高かった。
EUでは、欧州医薬品庁の指示により心血管系リスクを評価する製造販売後臨床試験(FAST試験)が実施中。日本における副作用報告では、PMDAに報告された重篤副作用397例555件のうち、心血管関連事象の報告は63例70件(転帰死亡は18例18件)だったが、フェブキソスタットと心血管関連事象または死亡との因果関係が否定できない症例はなかったとしている。
厚労省は、安全対策調査会に「現時点で本薬の適用患者を限定する等本薬の位置付けを変更する措置は必要ないと判断する」と提案し、了承された。その理由として▼一般に心血管系リスクは欧米人と比較して日本人では低いとの報告があり、また、東アジア民族において本薬群とアロプリノール群で心血管イベントおよび心血管死において差が認められていないとの研究報告があることを踏まえると、アジア民族の組み入れが3%であったCARES試験でのアロプリノールと本薬の心血管死のリスク差が日本人に外挿可能か否かは不明であること▼本薬とアロプリノールの心血管リスクまたは死亡リクスの差異はなかったとする人口ベースコホート研究が複数報告されていること-など4項目を挙げた。また厚労省は、添付文書においてCARES試験の結果を紹介することを提案し、了承された。